当涉及到药物开发时,膜蛋白起着至关重要的作用,大约50%的药物靶向这些分子。了解这些连接细胞膜的膜蛋白的功能,对于设计下一代强效药物非常重要。为了做到这一点,科学家们研究了模型蛋白,比如细菌视紫红质(bR),当被光触发时,它会将质子泵过细胞膜。
虽然bR已经被研究了半个世纪,但物理学家最近开发了一种技术来观察它在细胞脂质双层膜的天然环境中的折叠机制和能量学。
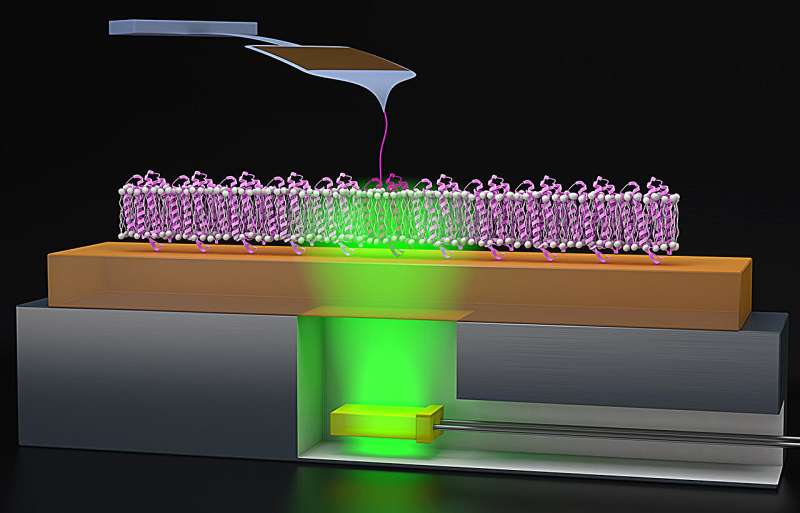
在《美国国家科学院院刊》(PNAS)上发表的一项新研究中,JILA研究员Thomas Perkins和他的团队通过将原子力显微镜(AFM)(一种传统的纳米科学测量工具)与精确定时的光触发器结合起来,实时研究蛋白质功能的功能,从而改进了这些方法。
珀金斯解释说:“膜蛋白的能量学研究一直具有挑战性,因此没有得到很好的理解。”“使用AFM和其他方法,我们可以创造出进一步研究这一问题的方法。”对这些蛋白质的能量学有了更好的了解,化学家可以设计出更有效的药物来治疗由蛋白质功能失调引起的特定症状和疾病。
测量毫秒级蛋白质动态
虽然bR是一种微小的蛋白质,但它可以用肉眼看到,甚至在卫星图像中也可以看到,当古菌微生物繁殖时,它们会在咸水池塘中留下大量的bR残渣。珀金斯说:“池塘里充满了所谓的盐酸盐杆菌,这是细菌紫质的母体。”“这些池塘是用来收获盐的,因为它们温暖而咸,细菌喜欢在那里生长。”
在微观层面上,bR与其他膜蛋白一起为细胞产生能量,方法是在细胞膜的一侧产生质子梯度,并将质子引导到膜的另一侧。bR通过折叠和展开它的螺旋形成特定的形状来控制有多少质子通过膜。在这个过程中,质子迁移产生三磷酸腺苷(ATP)形式的化学能。
对于珀金斯和他的合著者大卫·雅各布森(前JILA博士后研究员,现在是克莱姆森大学的助理教授)来说,bR提供了一个设计一种新的实验方法来观察实时功能能量学的机会。
为了研究像bR这样的蛋白质,雅各布森和帕金斯利用AFM,它就像一个小手指轻轻地拉蛋白质,这有助于AFM感觉蛋白质的表面,绘制出它的结构,更好地理解蛋白质是如何折叠的。
由于bR的折叠过程是由光触发的,珀金斯和雅各布森在AFM过程中添加了一个照明元素。珀金斯说:“我们想出了一个聪明的主意,把超薄的绿色led(可以触发细菌视紫红素)粘在一个金属冰球上,我们可以把它粘在AFM上。”“这些绿色led也很便宜,大约每只1美元或1.5美元。与我们的AFM悬臂梁相比,每个AFM悬臂梁的成本约为80美元,丢掉1.5美元的LED几乎不是我们担心的事情。”
珀金斯和雅各布森在他们的原子力显微镜(AFM)上添加了这种廉价的附加装置,可以诱导bR以毫秒级的精度折叠和展开。在收集了他们的数据后,研究人员发现蛋白质在60%的时间里正确折叠,允许质子穿过膜。
为了验证蛋白质折叠的能量学和实时功能,科学家们对bR蛋白进行了突变,使其始终处于“打开”或未折叠状态。利用他们的新实验装置,他们可以重现类似于他们之前在bR光循环的“开放”阶段观察到的发现。
“在生物学中,你可能会看到一些东西,但你需要问,我看到的是我认为我看到的吗?”珀金斯说。“因此,通过进行突变并看到我们预期的效果,我们增加了信心,我们真的在研究我们认为我们正在研究的过程。”
错误折叠蛋白质的奥秘
珀金斯和雅各布森在60%的情况下观察到正确的折叠,而另外40%的情况让他们感到惊讶,因为蛋白质折叠错误,但仍然可以通过膜泵出质子。“错误折叠实际上是稳定的,”帕金斯补充说。“这真的很令人惊讶。”在许多情况下,蛋白质错误折叠不会导致稳定。
由于能量稳定,珀金斯和雅各布森推测溴的结构螺旋没有正确分离,不能为质子提供一个完全开放的通道,尽管它仍然摆动着通过,这是一个很难用原子力显微镜成像检测到的过程。
为了更好地理解错误折叠的潜在机制,珀金斯和雅各布森将AFM拉力试验中的力降低到零,看看这是否会诱导蛋白质正确折叠。然而,结果保持不变:40%的病例导致折叠错误。
在相同数量的错误折叠情况下,这些结果让研究人员感到困惑。虽然帕金斯和雅各布森无法确定这些错误折叠病例的原因,但他们希望进一步调查。现在,他们很想知道生物物理学界的其他人对这些结果的看法。
珀金斯补充说:“可能会有更微妙的影响,或者可能会有一些新的科学发现。”“这可能是一条人们以前没有看到的途径。”